Как рассказывать в школе об открытиях и новостях науки
09.02.2016
По решению Международного союза теоретической и прикладной химии (IUPAC) в периодическую систему химических элементов добавлено сразу четыре новых химических элемента: Унунтрий (Uut) под номером 113, Унунпентий (Uup) под номером 115, Унунсептий (Uus) под номером 117 и Унуноктий (Uuo) под номером 118. Это первое дополнение таблицы Менделеева с 2011 года. Примечательно, что новые элементы были открыты при непосредственном участии российских ученых. Повлечет ли это открытие замену старых таблиц и учебников на новые и насколько серьезно к нему отнеслись современные учителя — рассказывает учитель химии и теории познания Гимназии № 45 имени Л. И. Мильграма Иван Сорокин.
То, что большой процент учебных материалов по любому естественно-научному предмету не вполне соответствует актуальным представлениям об этом предмете, известно многим — более того, многим это понятно и очевидно. Конечно, учебники должны регулярно обновляться — но вряд ли стоит перегружать школьника деталями, если они не меняют базового, парадигмального представления о природе той или иной отрасли знания.
Соглашаются с этим примерно все — но вот с определением слова «детали» возникают вопросы. Насколько фундаментальным должно быть изменение, чтобы сразу броситься выкидывать учебники? О чем можно умолчать, что можно упростить? В школьном курсе есть не так много тем, где эта противоречивость проявлялась бы столь же ярко, как в разговорах о теории строения атома и Периодическом законе.
Давайте попробуем ответить на несколько важных вопросов: возможно, ответы буду не вполне такими, как вы ожидаете.
1. Кто является автором современной версии Периодического закона?
Приоритет Дмитрия Ивановича Менделеева в создании периодического закона не оспаривает буквально никто — это действительно одно из главных достижений в истории российского науки (к счастью, имена двух его главных предшественников, Йохана Вольфганга Дёберайнера и Джона Ньюлендса, тоже регулярно упоминаются в соответствующих учебниках). Однако, как хорошо известно, исходно Менделеев располагал элементы в порядке увеличения атомного веса (с некоторыми исключениями: величие научной интуиции Менделеева позволило ему верно определить главенство химических свойств над атомным весом в описании периодичности). В современной же формулировке, хорошо описывающей имеющиеся экспериментальные данные и предсказывающей новые открытия, порядком элементов управляет зарядовое число, соответствующее числу протонов в ядре. Эту формулировку предложил Генри Мозли уже после смерти Менделеева — и незадолго до своей гибели на поле Первой Мировой, в возрасте 27 лет. Именно поэтому в названии Периодической таблицы за пределами России имя Менделеева обычно не используется (а вариант «Таблица Менделеева-Мозли» представляется совсем экзотическим).

2. Как выглядит современная атомная модель?
Практически в любом учебнике, несмотря на упоминания орбиталей и электронных облаков, для иллюстрации строения атома используются картинки с «сечением» атома и расположением электронов на определенных «орбитах» на разном отдалении от ядра. Такая модель, исходно предложенная Нильсом Бором, действительно была общепринятой какое-то время — где-то до 1927 года, когда формулировка квантово-механического уравнения Эрвином Шредингером, с одной стороны, и принципа неопределенности Вернером Гейзенбергом, с другой стороны, положила представлениям Бора конец. Действительно, вообразить вероятностный характер движения электрона в пространстве человеку довольно непросто (посмотрим правде в глаза: это относится почти любой базовой концепции квантовой механики). Но представления об орбиталях как о «траекториях», часто в явном или скрытом виде присутствующие в школьных учебниках по химии, противоречат самой природе квантовой теории.
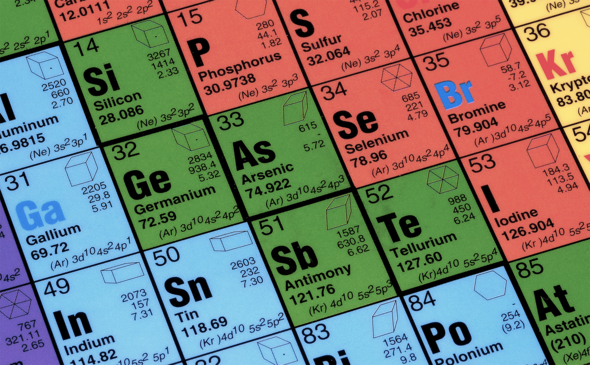
3. Как выглядит стандартное отображение периодической таблицы?
Быстро, в какой группе находится цинк? Если вы хорошо помните химию и закончили школу лет десять назад или раньше, очень велик шанс, что вы подумали про себя: «во второй». Поздравляем, вы вызвали виртуальное раздражение у ИЮПАК (главного международного органа, определяющего номенклатуру в химии)! В чем же дело? Короткопериодная версия Периодической таблицы, в которой переходные металлы (они же d-элементы) расположены во второй строчке периода, не используется уже практически нигде — кроме как на территории постсоветских стран. Объяснить это чем-то, кроме инерции, невозможно: короткопериодная версия таблицы — это наследие вышеупомянутого Ньюлендса и его октав; используя ее, запутаться в электронном строении разных элементов гораздо легче (а именно сходство и различие в электронном секретным образом является наиболее полезным типом информации в Периодической таблице). Несмотря на то, что и у длиннопериодной таблицы есть свои недостатки (так, лантаниды и актиниды в ней по настоянию все же вынесены вниз — иначе весь период-строчка не укладывался бы по ширине ни в один нормальный лист), именно она по сути является сейчас международным символом химии и формальной «азбукой» для написания химических реакций. Вам может показаться, что это всего лишь вопрос верстки — но практика показывает, что мнемонические ассоциации очень устойчивы, а переучивание с одной версии на другую дается не так просто (несмотря на то, что обе версии таблицы отражают один и тот же Периодический закон).
4. Каков размер Периодической таблицы?
Вопрос на определение возраста: что такое «курчатовий»? После того, как 104 элемент Периодической таблицы был синтезирован как советскими, так и американскими учеными, для определения первенства открытия понадобилось несколько десятилетий: в итоге окончательное название «резерфордий» было присвоено сто четвертому лишь в 1997 году. Но и после этого во многих русскоязычных учебниках название «курчатовий» продолжало жить на форзацах, становясь своеобразным зомби от химии. Почему так вышло? Дело в том, что тяжелые элементы, стоящие в таблице после урана и получаемые исключительно на дорогостоящих тяжеленных ускорителях в малейших количествах, не только не имеют практических приложений в силу крохотных времен жизни, но еще и не могут быть изучены на макро-уровне.
Фактически это значит, что шанс получить кусок какого-нибудь флеровия, чтобы изучить его реакции, стремится к нулю. Ну и зачем, спрашивается, переиздавать учебники, чтобы учесть эти новые данные? Несмотря на то, что открытие новых элементов часто представляют передним краем современной химии, изменения в длине Периодической таблицы (но не в ее возможном размере — никаких теоретических ограничений на размеры здесь попросту нет!) фактически представляют максимальный интерес только для нескольких небольших групп исследователей. Так что решение обратить более пристальное внимание на предыдущие вопросы выглядит гораздо более логичным, чем бесконечное переиздание учебников с новыми названиями в дальнем конце таблицы.