Химия, как и физика, в списке нелюбимых школьных предметов стабильно занимает верхние строчки. Но скучных предметов не бывает — бывает неправильное преподавание. «Мел» выбрал 18 увлекательных гифок, после просмотра которых школьникам (да и их родителям) наверняка захочется «похимичить». Всё происходящее на гифках объясняет учитель химии Иван Сорокин.
1. Метан
Газообразный метан легче воздуха, поэтому образованная им пена легко поднимается под потолок. Ну а яркое горение основного компонента природного газа удивлять никого не должно — то же самое можно сказать про любой лёгкий углеводород.

2. Реакция окисления люминола и гексацианоферрата (III) калия
Перед вами пример хемилюминесценции: в ходе превращения люминола наблюдается хорошо различимое человеческим глазом свечение. Красная кровяная соль выступает здесь в качестве катализатора — ту же роль, между прочим, может играть и гемоглобин, в результате чего описываемая реакция широко применяется в криминологии для обнаружения следов крови.

3. Воздушный шарик, наполненный ртутью (реакция при ударе об пол)
Ртуть — единственный металл, остающийся жидким в нормальных условиях, что позволяет залить его в воздушный шарик. Однако ртуть настолько тяжела, что даже падение шарика с небольшой высоты разорвёт его в клочья.

4. Разложение перекиси водорода, катализируемой йодидом калия
В отсутствие примесей водный раствор пероксида водорода вполне стабилен, но стоит внести в него йодид калия, как моментально начнётся разложение этих молекул. Оно сопровождается выделением молекулярного кислорода, прекрасно способствующего образованию различных пен.

5. Железо + сульфат меди
Одна из первых реакций, изучаемых в российском курсе химии: в результате замещения более активный металл (железо) растворяется и переходит в раствор, в то время как менее активный металл (медь) осаждается в виде цветных хлопьев. Как несложно догадаться, анимация сильно ускорена во времени.
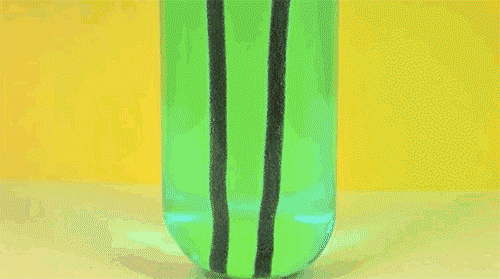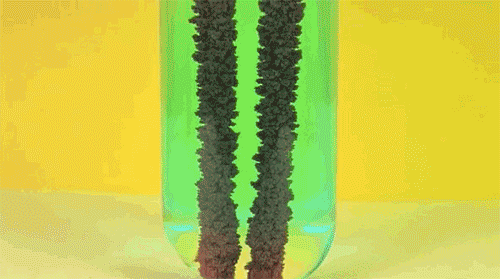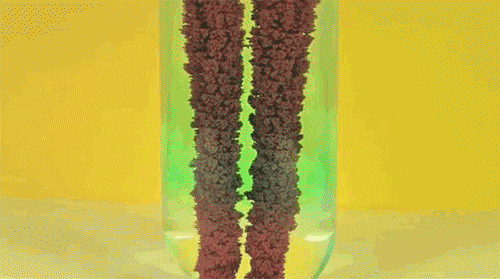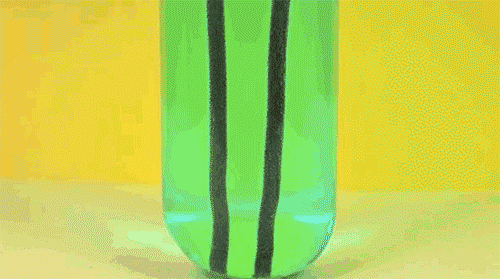
6. Перекись водорода и йодистый калий
Ещё один пример реакции разложения пероксида водорода (он же перекись) в присутствие катализатора. Обратите внимание на стоящую на столе бутылку моющего средства: именно она помогает появиться падающей на стол мыльной сосиске.

7. Горение лития
Литий — один из щелочных металлов, по праву считающихся наиболее активными среди всех прочих металлов. Он горит не столь интенсивно, как его собратья натрий и калий, но нетрудно убедиться, что этот процесс всё равно весьма быстрый.

8. Обезвоживание сахара в серной кислоте
Очень простая и очень эффектная реакция: серная кислота отнимает воду у молекул сахарозы, превращая их в атомарный углерод (попросту в уголь). Выделяющаяся при этом газообразная вода вспенивает уголь, благодаря чему мы видим угрожающий чёрный столб.

9. Кварцевое стекло
В отличие от стандартного оконного стекла, кварц более устойчив к высоким температурам: он не будет «течь» на обычной газовой горелке. Именно поэтому кварцевые трубки спаивают на кислородных горелках, обеспечивающих более высокую температуру пламени.

10. Флуоресцеин
В водном растворе под действием ультрафиолетового излучения зелёный краситель флуоресцеин испускает свет в видимом диапазоне — это явление называется флуоресценцией.

11. Молния в цилиндре
Реакция между сульфидом углерода и оксидом азота (I) не только сопровождается ярчайшей белой вспышкой, напоминающей шаровую молнию, но и характеризуется смешным звуком, благодаря которому она и получила своё популярное название — «лающая собака».

12. Горение борнометилового эфира
При реакции двух жидкостей, борной кислоты и метанола, образуется газообразный борнометиловый эфир, горящий симпатичным зелёным цветом (который характерен для соединений бора).

13. Йодид свинца
Аккуратно перекристаллизованный йодид свинца (II) отличается красивейшим золотистым цветом и блеском, который видно даже в темноте: неудивительно, что иногда это вещество пытаются выдать за драгоценный металл.

14. Лавовая лампа (растительное масло, вода, краситель и шипучие таблетки)
Эффектность лавовой лампы обеспечивается различным сродством красителя к воде и маслу — хорошо видно, что водная часть смеси почти не окрашена. Непрекращающееся движение пузырей обязано шипучим таблеткам: при их растворении выделяется углекислый газ, перемешивающий систему.

15. Термическое разложение тиоцианата ртути
Реакция, больше похожая на жизнедеятельность инопланетного разума, носит поэтическое название «фараоновы змеи». После её открытия в Германии продавались специальные наборы с тиоцианатом ртути, но после смертей нескольких детей, попробовавших на вкус ртутьсодержащий продукт, эту лавочку прикрыли.

16. Бихромат аммония
Один из самых известных опытов в неорганической химии является и одним из самых зрелищных: разложение ярко-оранжевых кристаллов дихромата аммония приводит к изменению степени окисления хрома (видно, что на дно банки падают уже зелёные хлопья).
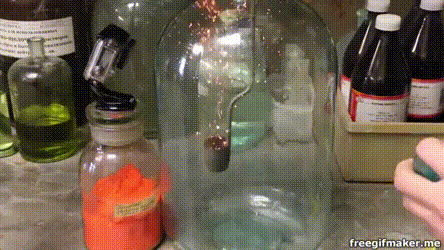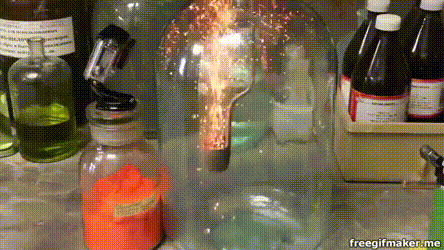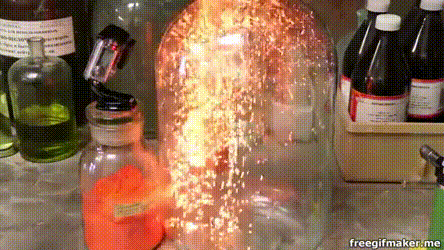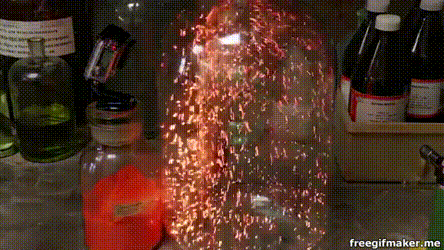
17. Серебро на меди
Несмотря на то что медь является драгоценным металлом, окислить её относительно просто. В частности, это по силам раствору нитрата серебра: здесь мы видим, как на погружённом в такой раствор медном кольце начинают расти тонкие серебряные кристаллы.

18. Хлорид кобальта и метасиликат натрия
Хлорид кобальта (II) имеет розовую или синюю окраску в зависимости от того, сколько молекул воды он связывает. И тут в игру вступает метасиликат натрия, являющийся прекрасным водоотнимающим агентом: именно он обеспечивает изменения цвета.














